Nature Communications(IF=17.69)在线发表了welcome皇冠地址登录入口饶义剑教授团队的原创性研究成果“Structural analysis of an anthrol reductase inspires enantioselective synthesis of enantiopure hydroxycycloketones and β-halohydrins”(Hou et al.,Nature Communications,2023, DOI:https://doi.org/10.1038/s41467-023-36064-4)。
手性酮的不对称还原,特别是以2,2-二取代-1,3-环二酮为原料去对称化反应合成光学纯的2,2-二取代-3-羟基环酮是一项具有挑战性的工作。基于课题组前期对贝第高林(Beticolin)生物合成路径的解析(Hou, 2022, Angew),鉴定出一种能够催化还原包括大黄素在内的多种大位阻底物的蒽酚还原酶CbAR,并首次解析了CbAR和CbAR-大黄素复合物的晶体结构。结构分析以及体外实验表明Tyr210在大黄素的识别和结合中起关键作用,它不仅与His162形成氢键相互作用,也与大黄素形成π-π堆叠相互作用,使得大黄素处于催化位点的正确取向,而确保产物的专一构象。随后,基于结构的蛋白质工程改造,CbAR-H162F突变体可以高效催化2,2-二取代的1,3-环二酮和α-卤代苯乙酮的不对称还原,得到了单一手性的产物。此外,解析了CbAR-H162F与上述两种底物的复合物晶体结构,清晰地揭示了它们的立体选择性机制。为此,本研究表明深入了解酶的催化机理对于蒽酚还原酶的底物拓展以及制备不同手性醇具有重要意义。
基于序列同源性分析,作者从尾孢菌中挖掘到一种潜在的蒽酚还原酶CbAR,它与包括17β-HSDcl在内的几种典型的蒽酚还原酶(MdpC、AflM、Arti和Arti-2)具有很高的序列同源性(Fig. 1b)。在Na2S2O4存在下,作者将1a,NADPH以及纯化获得的CbAR在绝氧环境下进行了反应测试。结果表明,2a的转化率为99%,ee>99%(Fig. 1a, c)。此外,考虑到17β-HSDcl可以催化雌酮(1b)的还原,作者还测试了CbAR是否能催化还原雌酮。如图1d所示,CbAR可以将1b及其类似物(1c,1d)转化为相应的雌二醇。由于2,2-二取代-3-羟基环酮是雌酮的一种合成砌块,因此作者认为CbAR具有催化前手性2,2-二取代1,3-环二酮生成相应手性醇的潜力。
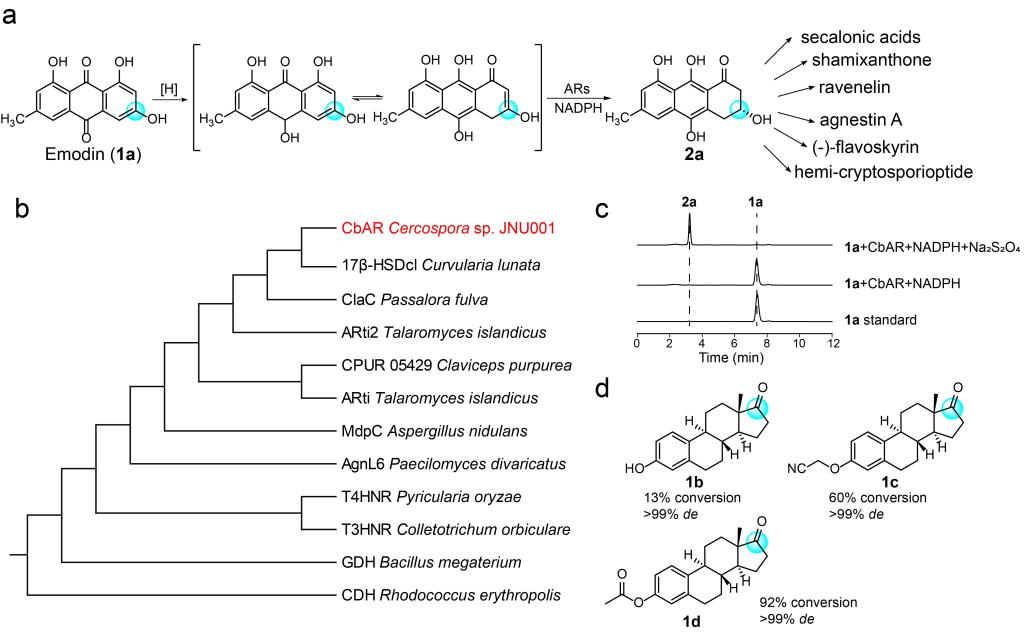
Figure 1.Identification of anthrol reductase CbAR with the ability to catalyze the reduction of emodin and estrones.
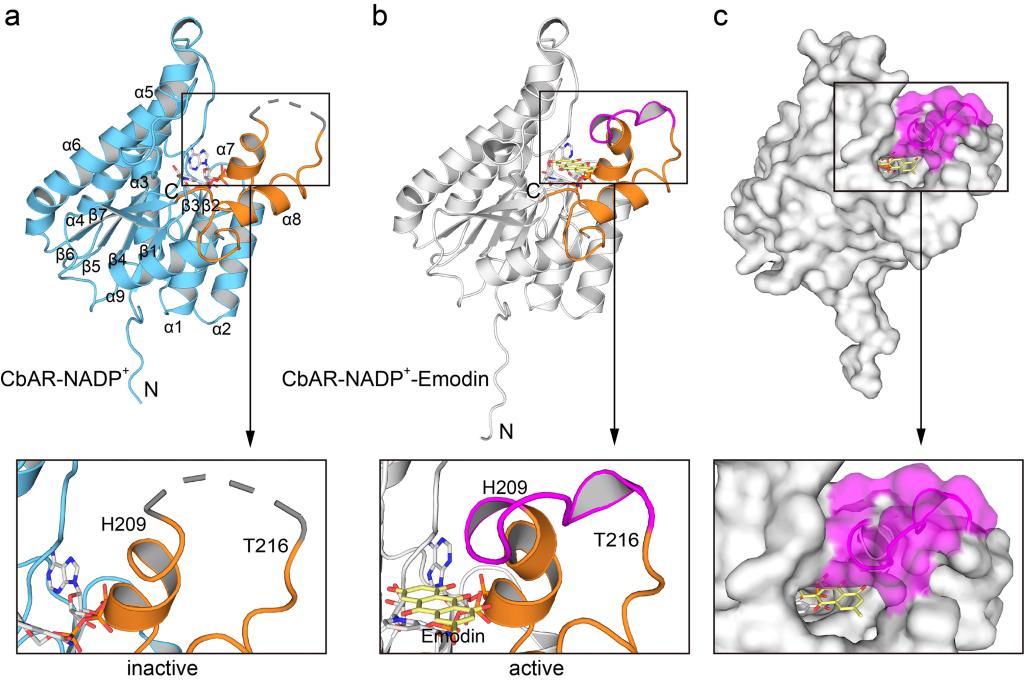
Figure 2.Overall crystal structure of CbAR in complex with NADP+or NADP+-Emodin.
为了进一步研究蒽酚还原酶催化过程中的分子机制,作者解析获得了CbAR和CbAR-大黄素复合物的晶体结构。CbAR单体的结构包含9个α-螺旋和2组β-Sheet(β1-β7)(Fig. 2a)。单体结构比对结果表明,虽然CbAR和CbAR-大黄素复合物的Cα原子的rmsd为0.25,但aa209-216的loop区域明显不同(Fig. 2a, b)。这一区域在CbAR-大黄素复合物的结构中可见,而在CbAR结构中观察不到,这表明该区域在底物识别和结合中起着关键作用。表面轮廓图进一步表明该区域可能是底物识别和结合的“大门”(Fig. 2c)。为了更好地理解aa209-216区域对底物识别和结合的重要性,作者进一步分析了大黄素与CbAR之间的详细相互作用。晶体结构及体外实验表明,除了催化三联体(Ser151,Tyr165和Lys169)外,Asn152、His162, Tyr210, Pro212和Pro219在大黄素的底物识别、结合和稳定中也起着关键作用(Fig. 3)。

Figure 3.Molecular insights and characterization of emodin recognition and binding of CbAR.
由于2,2-二取代的1,3-环二酮有两个手性中心,因此在合成化学中制备光学纯的2,2-二取代-3-羟基环酮是一个很大的挑战。考虑到CbAR可以适应不同的大位阻底物(Fig. 1d),因此作者使用CbAR对1e的还原进行了测试。结果表明,虽然CbAR对这种底物的催化效率较低,但是具有良好的立体选择性。随后,经过基于结构的蛋白质工程改造,作者选择活性最高的CbAR-H162F突变体进行了底物范围的探索。结果表明H162F对于几种2,2-二取代-1,3-环二酮的底物都有较好的转化率和极高的立体选择性(Fig. 4a, b)。随后,作者通过H162F-1e复合物的晶体结构揭示了H162F催化这类底物的分子机制(Fig. 4c, d)。
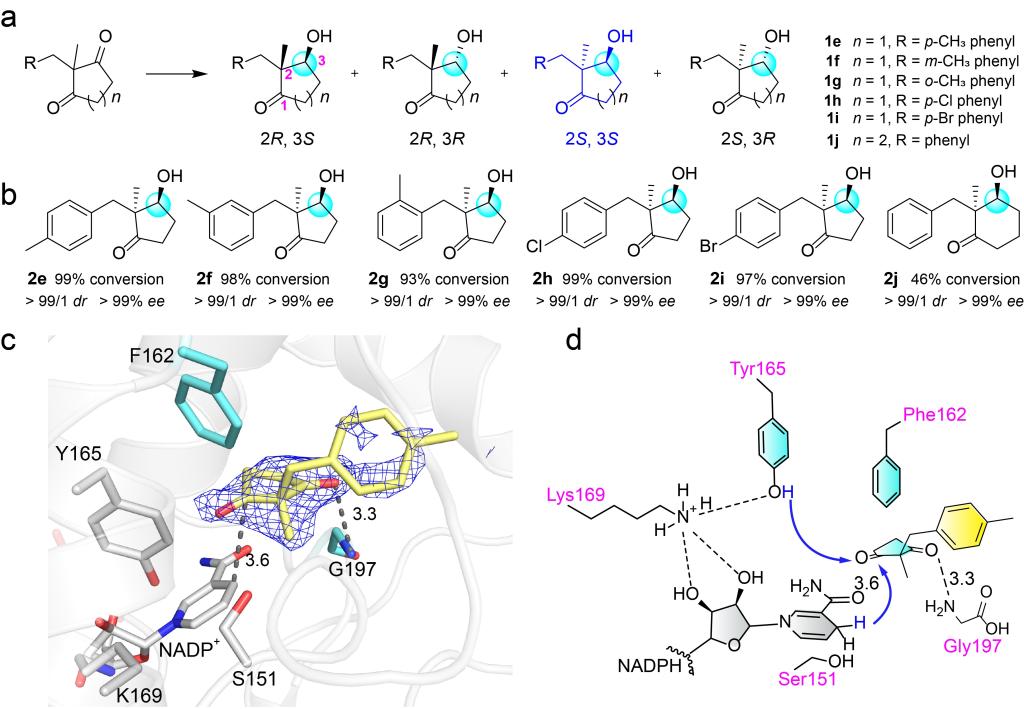
Figure 4.Molecular insights of reductive desymmetrization of 2,2-disubstituted prochiral 1,3-cyclodiketones for the preparation of (2S,3S)-2,2-disubstituted-3-hydroxycycloketones by CbAR-H162F.
最后,作者进一步探索了H162F的底物谱。以1k和1l为研究对象,测试它们能否被转化为相应的手性醇(Fig. 5a),结果表明,两种底物都不能被CbAR转化为相应的产物,而1l可以被CbAR-H162F还原为β-卤代醇(2l),且具有良好的对映选择性(>99%ee)(Fig. 5b)。此外,H162F还可以催化1m、1l和1n生成相应的光学纯的产物图(Fig. 5b)。随后,作者通过H162F-1o复合物的晶体结构揭示了H162F催化这类底物的分子机制(Fig. 5c, d)。

Figure 5.Molecular insights of asymmetric reduction of α-haloacetophenones for the preparation of β-halohydrins by CbAR-H162F.
welcome皇冠地址登录入口2018博士生侯晓冬和许会宾为该论文的共同第一作者,饶义剑教授为该论文的唯一通讯作者。上述研究工作得到了国家重点研发计划(2021YFC2102700),国家自然科学基金(32270082),江苏省自然科学基金(BK20202002)和江苏省研究生科研创新计划(KYCX20_1812 & KYCX20_1816)等基金资助。近年来饶义剑教授团队在“复杂天然产物(药物)的生物合成与应用,以及重要生物转化过程与生物催化反应”等方面取得一系列进展,相关研究成果以通讯作者在Nature Communications(2023)、Angew(2022)、ACS Catalysis(2020, 2021, 2022)、Water Research(2022)、Chem Eng J(2021)、J Hazard Mater(2021)、Green Chem(2019, 2022)等权威期刊发表。
