近期,皇冠官网welcome皇冠地址登录入口康振教授团队在水蛭透明质酸酶结构与切割模式机制解析方面取得重要进展,研究成果“Structure and cleavage pattern of a hyaluronate 3-glycanohydrolase in the glycoside hydrolase 79 family”正式发表于Carbohydrate Polymers (IF=9.381)(https://doi.org/10.1016/j.carbpol.2021.118838)。
作为透明质酸分解代谢的关键参与者,透明质酸酶参与多种生理和病理过程,被广泛应用于医药领域。根据催化机制及水解产物的不同,透明质酸酶主要分为三类,其中分别水解及裂解β-1,4糖苷键的两类透明质酸酶的蛋白结构及催化机制已经被广泛研究,然而对于水解β-1,3糖苷键的第三类透明质酸酶的信息则知之甚少。
针对该问题,该研究首次解析了特异性水解β-1,3糖苷键的水蛭透明质酸酶(LHyal)的晶体结构,LHyal具有糖苷水解酶79家族(GH79)的经典结构特征,由一个(β/α)8-桶状催化结构域和一个β-sandwich结构域组成。通过与其他GH79家族蛋白进行结构比对分析,LHyal在结合裂缝一侧具有一个较长的loop环,而该区域影响糖苷水解酶切割底物的作用模式。使用分子对接并进行定点突变实验,确定了位于活性位点裂缝中的关键氨基酸残基。此外,上述loop环中的两个碱性氨基酸R102和K103通过与带负电的透明质酸发生静电相互作用,对于底物结合至关重要。最后,制备了一系列不同长度的奇数及偶数透明质酸寡糖,并用于探究LHyal的识别和裂解模式。结果表明LHyal的天然最小底物是六糖,且糖链在结合裂缝内占据五个结合亚位点是切割所必需的。该研究为进一步理解透明质酸的降解机制及GH79家族蛋白进化的关系提供了新的思路。
陈坚院士、康振教授和饶义剑教授为论文的共同通讯作者,welcome皇冠地址登录入口2017级博士生黄浩为论文第一作者。上述研究得到了国家重研发计划(2021YFC2100800)、江苏省杰出青年科学基金(BK20200025)、国家自然科学基金(32000058)、江苏省科技支撑项目(BE2019630),轻工技术与工程国家一流学科项目(LITE2018-16)的资助。
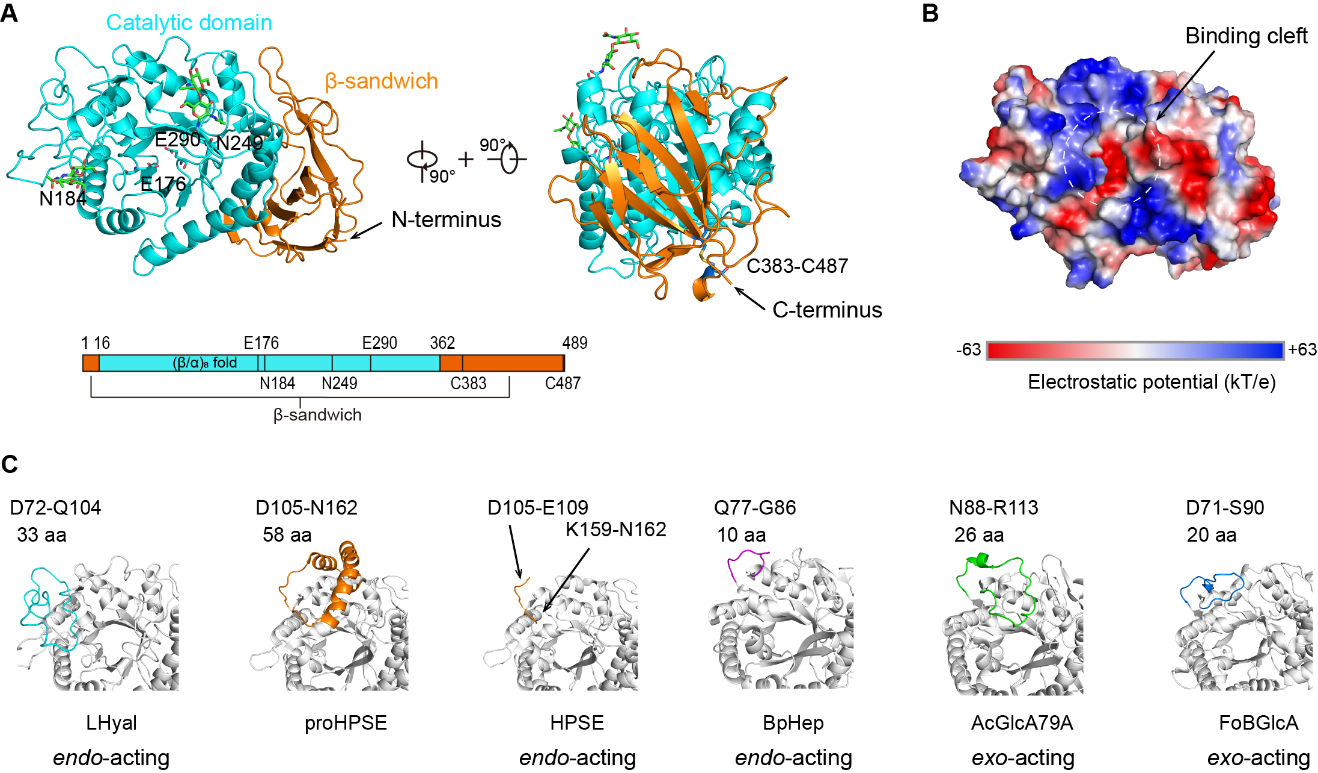
图1 LHyal的晶体结构以及GH79家族蛋白的‘exo-pocket’ loop比较
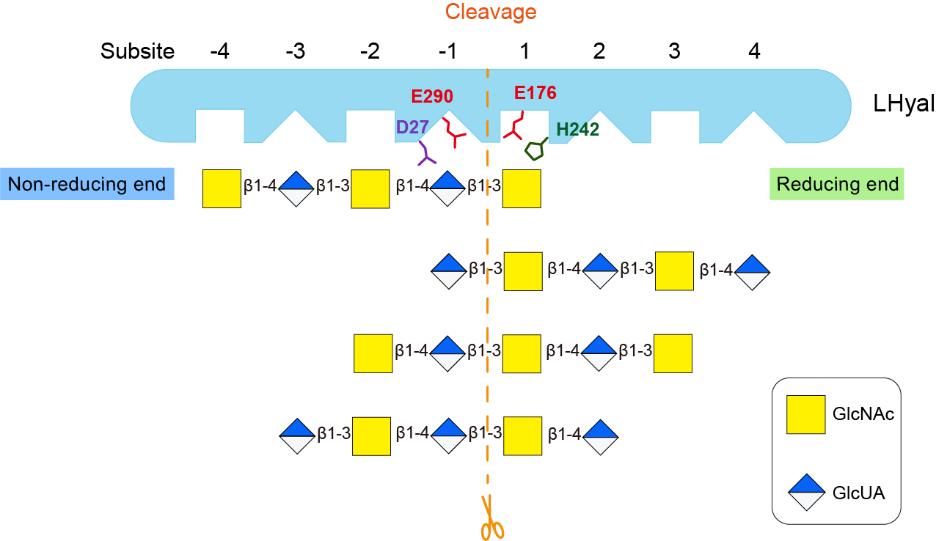
图1 LHyal的晶体结构以及GH79家族蛋白的‘exo-pocket’ loop比较
