近期,皇冠官网welcome皇冠地址登录入口康振教授团队在PAPS合成相关研究取得重要进展,研究成果“Closed-Loop System Driven by ADP Phosphorylation from Pyrophosphate Affords Equimolar Transformation of ATP to 3′-Phosphoadenosine-5′-phosphosulfate”以封面形式正式发表于ACS Catalysis (IF=13.084) (https://pubs.acs.org/doi/10.1021/acscatal.1c02004)。
3′-磷酸腺苷-5′-磷酸硫酸(PAPS)是生物体内所有生物磺酸化反应的通用磺酸基团供体。生物制造含磺酸基团化合物 (如肝素和硫酸软骨素)的需求推动了PAPS体外合成的研究。天然PAPS酶法合成面临着转化率低 (2 mol ATP只能合成1 mol PAPS)50%与高成本的障碍。针对现有问题,研究人员开发了一条理论转化率为100%的PAPS合成路线,该路线提供了ATP等摩尔转化为PAPS的条件。
首先通过融合来自不同物种的腺苷5′-三磷酸硫酰化酶和腺苷5′-磷酸硫酸激酶,人工创造了一种具有活性的双功能酶来直接将ATP转化为PAPS,显著提高了转化率;为了最大限度地将ATP转化为PAPS,通过筛选消耗低成本聚磷酸作为高能磷酸供体的聚磷酸激酶,设计并构建了依赖于聚磷酸盐的ATP再生系统。研究人员发现焦磷酸PPi可以作为磷酸供体,通过聚磷酸激酶将ADP磷酸化为ATP。在证明了PPi激酶活性在聚磷酸激酶中的广泛分布后,最终建立了一条闭环ATP再生途径,实现了PAPS的高效廉价催化合成。本研究通过构建的低成本高效酶法合成PAPS路线,对于促进磺酸化合物生物合成具有重要的意义。
康振教授为通讯作者。welcome皇冠地址登录入口2020级博士生胥睿睿和副研究员王阳为该论文共同第一作者。上述研究得到了国家重研发计划 (2021YFC2100800)、江苏省杰出青年科学基金 (BK20200025)、国家自然科学基金 (32000058、31970085)、关键技术资助江苏省研发计划 (BE2019630),国家轻工技术与工程一流学科(LITE2018-16)的资助。

图1 文章封面

图2 人工PAPS合成双功能酶的构建
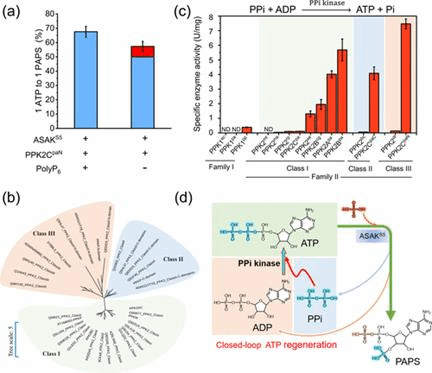
图3 焦磷酸激酶活性分布及闭合循环合成PAPS示意图
